D Vitaminin Sağlık Faydaları İçin Yalnız D Vitamini Takviyesi Yeterli Mi? VDR’nin Önemi
İnsanlar, D vitaminiyle ilişkili faydaları elde etmek için yalnızca vitamin D3 takviyesi almalarının yeterli olduğunu düşünür. Oysa çoğu zaman vitamin D3 tek başına yeterli değildir. Vitamin D Reseptörü (VDR) de son derece önemli çok sayıda işleve sahiptir.
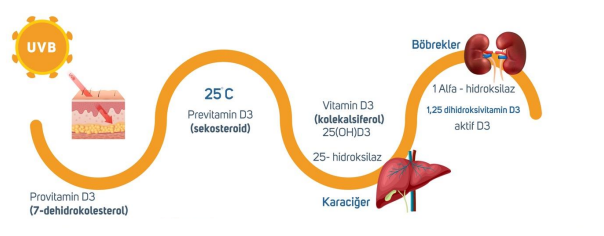
Aktif Vitamin D Eldesi Ve Sonrası İçin Gereken Koşullar
Vitamin D3’ü birçok sağlık etkisinin nedeni olarak düşünürüz; ancak gerçekte vitamin D3, bu faydalara giden sürecin yalnızca başlangıcıdır.
Güneş ışınlarındaki UVB ışınlarının uygun koşullar* altında çıplak tenimize değmesinin ardından farklı organlarda gerçekleşen bir dizi enzimatik reaksiyona ihtiyaç duyulmaktadır. Enzim demek protein demektir. Protein demek onu kodlayan gen dizisi demektir.
*Uygun Koşullar: Bulunulan coğrafyada güneşin Zenith açısının en kısa olduğu dönemlerde ( TR için Mayıs-Ekim, öğle saatleri) 290-310 nm dalga boyundaki güneş ışınlarının, arada bir bariyer olmaksızın, direkt olarak, çıplak ve koyu renkli olmayan, güneş kremi sürülememiş insan derisinin cm2 si basina yaklaşık 10 dk boyunca 18-20 mJ düşmesi ile 10.000-20.000IU D vitamini üretilebilmektedir.
Provitamin D3 ultraviole B (UVB) ışınlarının cilde değmesinin akabinde previtamin D3’e dönüşmektedir. Previtamin D3 ise karaciğerde CYP2R1 geninin kodladığı 25-hidroksilaz enzimi ile Vitamin D3’e (25-OH-D3/kolekalsiferol)’e dönüşmektedir.
Vitamin D3 eldesine kadar geçmesi gereken yollar başarıyla aşılsa bile bu yeterli olmamakta Vitamin D3’ün, aktif formu olan kalsitriol’e (calcitriol) dönüştürülmesi gerekmektedir. Bu olay da böbreklerde gerçekleşmekte olup CYP27B1 geninin kodladığı 1-alfa hdroksilaz enzimi ile kolekalsiferol aktif form kalsitriole (1,25 dihidroksivitamin D3) dönüşmektedir. (Kalsitroilün fazlası da CYP24A1 tarafındna kodlanan 24 hidroksilaz ile inaktive edilmektedir.) Şekil 1.
Şekil 1.

Daha sonra da kalsitriolün taşıyıcı proteinlerle (GC) taşınarak Vitamin D Reseptörü’ne (VDR) başarıyla bağlanması gerekmektedir. Bu da sağlıklı bir taşıyıcı protein genetik kodu ile reseptör yapısı gerektirmektedir.
Oldukça sık rastlanılan tek nükleotid polimorfizmleri (SNP) gibi genetik sorunların dışında bazı enfeksiyonlar ve toksinlerin de bu reseptörleri bloke ettiği bilinmektedir. Böyle durumlarda ne kalsitriolün ne de vitamin D3’ün sağlık faydaları ortaya çıkmamaktadır.
Kalsitriol VDR’ye başarıyla bağlanabildikten sonra, normal hücre çoğalması ve apopitoz gibi birçok fizyolojik işlevin sürdürülebilmesi için özel bir vitamin- reseptör kompleksinin oluşması gerekmektedir. Bu kompleks; nükleer reseptör süper ailesinin önemli bir üyesidir. Kompleksin tamamlanabilmesi için VDR’ye bağlanmış kalsitriolün, aktif A vitamini tarafından aktive edilen Retinoid X Reseptörüne (RXR) bağlanarak dimer oluşturması gerekmektedir. Hücre çekirdeğine ulaşan VDR-kalsitrol-RXR kompleksi promotor bölgesinde Vitamin D Response Element (VDRE) bulunan genleri regüle edebilir. Şekil 2.
Şekil 2.

İşte tüm bunların ardından, hücreye özgü yanıtlar oluşabilir ve vitamin D’nin etkilerini düzenleyen proteinleri kodlayan belirli genlerin ekspresyonu kontrol edilebilir. Burada gerçekleşen gen ekspresyonları, tüm genetik kodda gerçekleşen ekspresyonların %10’unu teşkil etmektedir. Yaklaşık 31 organda VDR bulunduğu düşünülürse bu oran hayatta kalmanın ve sağlıklı yaşamın sürdürülmesi için Vitamin D3 ve sonrasında gelişen tüm olayların ne denli önemli olduğunu ortaya koymaktadır.
O halde D vitaminin sağlık faydalarını görebilmek için gerekenler, önce yeterli miktarda D vitaminidir. Bu aşamada takviyeler kıymetli. Ancak aktif D vitamini elde etmek için sağlıklı bir genetik kod, sağlıklı enzimler, sağlıklı taşıyıcılar, sağlıklı bir reseptör, A vitamini ile aktive edilmiş RXR da gerektiğini unutmayalım. Bu nedenle A vitamini de gerekirse takviye edilebilir. Genetik kodumuzu değiştirebildiğimizi Epigenetik Bilimi bize öğrettiğine göre; yaşam tarzımız ve beslenme seçimlerimizle genetik kodlarımızı optimize etmeye çalışmak da kıymetli
olacaktır.
Vitamin D3’ün Faydaları
Vitamin D’nin aktif formu olan kalsitriolün çok sayıda faydası vardır. Vitamin D şunlara karşı koruma sağlar:
-
Osteoporoz
-
Kanser
-
Diyabet (Tip 1 ve Tip 2)
-
Kalp hastalıkları
-
Nörolojik hastalıklar
-
Sedef hastalığı (Psoriasis)
-
Enfeksiyonlar
-
Multipl skleroz
-
Astım
-
Böbrek iltihabı ve böbrek hastalığına bağlı ölüm (kreatinin düzeylerini düşürmesi beklenir)
-
Yüksek tansiyon (Renin/anjiyotensin sistemini baskılar)
-
Lupus / SLE
-
Artrit
-
Skleroderma
-
Sarkoidoz
-
Sjögren sendromu
-
Otoimmün tiroid hastalıkları (Hashimoto, Graves)
-
Ankilozan spondilit
-
Reiter sendromu
-
Üveit
Vitamin D özellikle Th1 ve Th17 baskın bağışıklık profiline sahip kişiler için faydalıdır.
Vitamin D’nin Anti-İnflamatuar Rolü
Vitamin D esas olarak adaptif bağışıklık sistemini baskılar:
-
B hücre çoğalmasını inhibe eder
-
İmmünoglobulin (Ig) salgısını azaltır
-
T hücre çoğalmasını inhibe eder
-
Th1’den Th2’ye kayma sağlar
-
Th17’yi baskılar
-
Treg’leri ve IL-10’u artırır
-
İnflamatuar sitokinleri azaltır (IL-1, IL-6, IL-8, IL-12, TNF-α, IL-17, IL-21)
-
TGF-beta’yı düşürür
-
MHC II ve eş-uyarıcı moleküllerin ekspresyonunu azaltarak dendritik hücre farklılaşmasını ve olgunlaşmasını inhibe eder
Bağışıklık Sistemini Güçlendirmesi
Vitamin D aynı zamanda doğal (innate) bağışıklık sistemini uyarır:
-
T hücre aktivasyonu için kritiktir; bu açıdan bağışıklık güçlendirici etki gösterir
-
Viral enfeksiyonların kontrolünde önemli olan CD8+ T hücrelerini artırır
-
Doğal öldürücü T hücrelerini (NKT) artırır – otoimmün hastalıklar için faydalı, astım için olumsuz olabilir
-
NK hücrelerini artırır
-
Enfeksiyona yanıt olarak katelisidin ve beta-defensin-4 gibi antimikrobiyal maddelerin salınımını artırır
Vitamin D Reseptörünün Diğer Faydaları
Vitamin D3’ün en bilinen faydası kemik sağlığıdır.
-
Düşük D3 kan seviyeleri, düşük kemik yoğunluğu ile ilişkilidir
-
Klinik çalışmalar, kalsitriolün düşük kemik yoğunluğu olan kişiler için faydalı olduğunu göstermiştir
VDR aktivasyonu, ilaç ve toksin metabolizmasında önemli rol oynayan karaciğer ve bağırsak Faz I detoks enzimlerinin (ör. CYP2C9, CYP3A4) ekspresyonunu artırır.
Vitamin D Reseptörü saç büyümesi için önemlidir; deney hayvanlarında VDR kaybı saç dökülmesiyle ilişkilidir.
VDR, bağırsaklardan kalsiyum, demir ve diğer minerallerin taşınmasını düzenler.
Birçok enfeksiyon VDR’yi bloke ettiğinden, vücut bu patojenlerle etkili şekilde savaşamaz. Araştırmacılar, birçok durumda kalsitriol + antibiyotik kombinasyonlarını başarılı şekilde kullanmaktadır. Bağışıklık tepkilerini azaltmak için patojenlerin yıllar içinde yavaş yavaş ortadan kaldırılması önerilir.
Kalsitriol/VDR, dopamin üretimindeki hız kısıtlayıcı enzim olan tirozin hidroksilazı artırarak dopamin düzeylerini yükseltir.
Bu etki hipotalamus, adrenal bezler, substantia nigra ve muhtemelen diğer beyin bölgelerinde görülür. Bu durum dopamin, adrenalin ve noradrenalin üretimini artırır. Ancak tirozin hidroksilaz aynı zamanda oksidatif stresi artırabilir.
Kalsitriol GAD67’yi artırarak GABA seviyelerini yükseltir. Kalsitriol, dopamin nöronlarını koruyan GDNF’yi artırır (in-vitro).
Araştırmacılar, dolaşımdaki D vitamini yetersizliğinin Parkinson hastalığında dopaminerjik dejenerasyonun görüldüğü substantia nigra fonksiyon bozukluğuna yol açabileceğini öne sürmektedir.
Parkinson hastalarında D vitamini eksikliği yaygındır ve hastalık düşük kemik mineral yoğunluğu ile ilişkilidir.
Aktif D’nin kanser üzerindeki etkileri dokuya göre değişir.
-
Meme kanserinde östrojen ve aromataz azalır, testosteron/androjenler artar (olumlu)
-
Adrenal kanserde DHT azalır (olumlu)
-
Prostat kanserinde testosteron ve DHT artar (olumsuz)
Akciğer ve meme kanserinde, aktif D’yi parçalayan enzimin yüksek olduğu görülmüştür; bu da aktif D seviyelerinin artırılmasının faydalı olabileceğini düşündürür.
Aktif vitamin D prolaktin üretimini artırır.
Teknik: 1,25D; kemik mineral remodelasyonu için RANKL, SPP1 ve osteokalsini; bağırsak kalsiyum emilimi için TRPV6, CaBP(9k) ve claudin-2’yi; böbrekte kalsiyum ve fosfat geri emilimi için TRPV5, klotho ve Npt2c’yi düzenler.
Kalsitriol ve Vitamin D Reseptörü (VDR) Gen İfadesini Artırmanın Doğal Yolları
-
Egzersiz – kalsitriolu artırır.
-
RXR (ve retinol), VDR ile protein üretmek için gereklidir. 1,25-D3 VDR’ye bağlanır; ardından RXR ile birleşerek gen ifadesini aktive eder. (Tüm VDR-bağımlı genler RXR gerektirmez.)
-
Lactobasillus rhamnossus GG ve L. reuteri probiyotik desteği
-
Paratiroid hormonu (PTH) – Kalsitriol/1,25 D3’ü artırır ve PTH-ilişkili peptidi artırır,
-
SIRT1 – VDR’yi potansiyalize eder – VDR’nin asetilasyonu 1,25D/VDR sinyallemesini azaltır. SIRT1, VDR’nin RXR ile ilişki kurma/bağlanma yeteneğini artırdı.
-
PGC-1a – VDR’yi potansiyalize eder. VDR’nin bir ko-aktivatorüdür, ancak yine de 1,25D3’e ihtiyaç duyar.
-
Dopamin
-
Safra – özellikle Litokolik asit veya LCA. VDR, antik rolü bir detoksifikasyon nükleer reseptörü olan yapıdan evrimleşmiştir. LCA, bağırsak bakterilerinden üretilir (karaciğer kaynaklı kenodeoksikolik asidin metabolize edilmesiyle). LCA kolona gider; burada VDR, LCA’ya veya 1,25 D’ye bağlanır ve CYP3A4 ile SULT2A genlerini aktive eder; bu genler ABC efluks taşıyıcısı aracılığıyla hücreden uzaklaştırılmayı kolaylaştırır.
-
Omega-3: DHA, EPA – Balık yağı/DHA
-
Omega-6: γ-Linolenik asit, Araşidonik asit
-
Kurkumin – Kurkumin, VDR-aracılı transkripsiyonu sürüklemede LCA/safradan daha aktiftir ve VDR’ye yaklaşık LCA ile aynı afinitte bağlanır.
-
Resveratrol – VDR’yi şu yollarla potansiyalize eder: (1) 1,25D’nin VDR’ye bağlanmasını potansiyalize ederek; (2) RXR’yi aktive ederek; (3) SIRT1’i uyararak
-
Forskolin – in-vitro ortamda 25D3’ten 1,25D3’ü artırır
-
Gama Tokotrienol – Tokotrienoller veya Tokopheroller (IHERB)
-
Vitamin E/alfa-tokoferol – kalsitriol ile VDR için rekabet etmez.
-
Deksametazon – 1,25 ile rekabet etmez
-
Interferon-gamma – IFN-γ tedavisi, 1,25D3’ün 24-hidroksilaz (1,25 D3’ü parçalayan enzim) indüksiyonunu inhibe etti. Bu, 1,25D3’ün arttığı anlamına gelir. (Teknik: IFNy promotörün bazal düzey aktivitesini değiştirmedi ve 1,25 D’nin VDR’ye bağlanmasını
veya nükleer VDR düzeylerini değiştirmedi. IFN-γ, Stat1 aracılı bir mekanizma üzerinden VDR-RXR’nin VDRE’ye bağlanmasını bozar)
-
Estradiol, VDR ifadesini ve kalsitriol düzeylerini artırır.
-
Fitoöstrojenler
-
Testosteron
-
Prostaglandinler
-
Bisfosfonatlar
DHA, EPA, linoleik asit ve araşidonik asidin tamamı, VDR’yi aktive etmede 1,25 D3’e kıyasla
10.000 kat daha az etkilidir.
Kurkumin, VDR gen ifadesini indüklemede 1,25 D3’e kıyasla 1.000 kat daha az etkilidir. Kurkumin ve safra, VDR’ye benzer bağlanma yeteneğine ve benzer gen ifadesi düzeylerine sahiptir.
Kurkumin, safra, DHA, EPA, araşidonik asidin tamamı, bağlanma için 1,25 D3 ile rekabet eder. Deksametazon ve alfa-tokoferol rekabet etmez.
Doğal olarak şu soru akla gelir: Bunlar rekabetçi bağlayıcılarsa ve VDR’ye çok daha düşük bağlanma kapasitesine sahipseler, işe yararlar mı? Cevap evet gibi görünüyor.
PUFA’ların yüksek konsantrasyonları seçili hücrelerde veya dokularda oluşabilir ve biyolojik aktivite gösterebilir.
Farelere verilen aşırı safra/LCA, 1,25D3’ün oluşturacağı etkiyle aynı etkiyi oluşturdu (özellikle kalsiyum taşınımı aktivasyonu).
Böbrek bez dokusu bir miktar 1,25 vitamin D içerebilir.
VDR veya Kalsitriolu Baskılayan Faktörler
-
Kafein
-
Kortizol / glukokortikoidler
-
Prolaktin
-
Tiroid hormonları
-
TGF-beta
-
TNF
-
Kortikosteroidler
-
Fosfatonin, ketokonazol, heparin, tiazidler
-
Ubiquitin
Vitamin D Reseptörünü (VDR) İnhibe Eden Patojenler
Birçok patojen, vitamin D sisteminin bazı yönlerini inhibe eder — ya VDR’yi, ya moleküllerin VDR’ye bağlanabilme yeteneğini, ya da VDR’nin gen ifadesi oluşturma kapasitesini. Bunlar bazı örnekler; ama bilimin mevcut birikiminde bilinenlerin hepsini kapsadığımı sanmıyorum.
-
-
P. aeruginosa (çoğu zaman hastane kaynaklı). “Sülfonolipid ligandı capnine” üretir. Antibiyotikler iyi çalışmaz.
-
H. pylori (mide ülserlerinden sorumlu). Dünya nüfusunun %50’sinde bulunur. “Sülfonolipid ligandı capnine” üretir.
-
Lyme/Borrelia – Canlı Borrelia (monositlerde) VDR’yi 50 kat azaltır ve “ölü” Borrelia 8 kat azaltır – Bu, insanların Lyme enfeksiyonundan sonra neden otoimmün durumlar geliştirdiğini açıklayabilir.
-
Tüberküloz – VDR’yi 3,3 kat azaltır.
-
“Kayarak hareket eden” biyofilm bakterilerinin Capnine oluşturduğu
-
gösterilmiştir – Capnine (Cytophaga, Capnocytophaga, Sporocytophaga ve Flexibacter)
-
-
Chlamydia (trachomatis)
-
Shigella – dışkıda bulunan ve bağırsak problemleri ile ishale neden olan
-
bakteri. VDR yapısını parçalayan ve böylece VDR’nin gen transkripsiyonu yapma yeteneğini sınırlayan bir protein olan Kaspaz-3’ü artırır.
-
-
Mycobacterium leprase – VDR ile ilişkili birden çok geni hedeflemek için mir- 21 üretir.
-
Epstein-Barr virüsü (EBV) – VDR’yi yaklaşık beş kat azaltır. EBV ayrıca VDR’nin ürünler üretme yeteneğini de bloke eder.
-
HIV – VDR’ye bağlanır ve aktif D’ye dönüşümü inhibe eder.
-
Aspergillus fumigatus – Kistik fibroz hastalarında, A. fumigatus mantarının gliotoksin salgıladığı gösterilmiştir; bu toksin doza bağlı şekilde VDR’yi azaltır.
-
Sitomegalovirüs – CMV, VDR’yi 2,2 kat azaltır.
-
Hepatit C virüsü – Fazla 1,25-D’yi parçalamaktan sorumlu enzim olan CYP24A1’i inhibe eder.
-
Bakteriyel ürünler VDR’yi bloke ettiğinde, daha az CYP24A1 üretilir; bu da birçok otoimmün durumda görüldüğü gibi aktif vitamin D’nin fazlalığına yol açar.
Yüksek Kalsitriol Düzeyleri Enflamatuvar/Otoimmün Hastalığı İşaret Eder
Bakteriyel ürünler VDR’nin aktivitesini bozdukça, reseptörün kalsitriol/1,25-D’yi inaktif metabolitlerine parçalayan bir enzimi (CYP24) ifade etmesi engellenir. Bu da 1,25-D düzeylerinin, onları dengede tutacak bir geri bildirim sistemi olmadan yükselmesine izin verir ve hormonun yüksek düzeylerine yol açar.
Çalışmalar, kanda belirgin yüksek kalsiyum vakaları olmamasına rağmen, bu otoimmün durumlar ile 110 pmol/L’nin (46 pg/mL) üzerindeki 1,25-D düzeyleri arasında güçlü bir ilişki olduğunu gösteriyor. Otoimmün durumu olan 100 kişilik bir grupta, 38 kişinin 160 pmol/L’nin (66,6 pg/mL) üzerinde değeri vardı.
Kronik enflamasyonu olanlarda, aktif vitamin D düzeylerinin sıklıkla 50–80 pg/mL arasında bulunduğuna rastlanır.
Buna karşılık, D vitamini eksikliği veya diğer enflamasyon belirteçleriyle çok az ilişki vardır; yani kanda D vitamini 3 veya 1,25-D düzeylerinin otoimmün hastalık durumunu ölçmek için hassas bir ölçüt olduğu varsayılabilir.
Edinilmiş hormon direnci; insülin, tiroid, steroid ve büyüme hormonu salgılayan hormon (GHRH) ile de tanınmıştır ve bazı otoimmün durumlarda hormonların yüksek düzeyleri görülür.
Vitamin D3’ün Kalsitriol Düzeylerini Anlamak
Yaygın kan testleri, ne kadar aktif vitamin D’niz olduğunu gösteren çeşitli belirteçleri ölçer.
Aşağıdakiler daha yüksek kalsitriolü işaret eder:
-
-
Daha yüksek paratiroid hormonları
-
Daha yüksek kan kalsiyumu ve fosfor
-
Daha yüksek albümin
-
Daha yüksek kreatinin
-
Daha düşük alkalen fosfataz
Bunların en azından bir kısmı (belki de hepsi) vitamin D reseptörünü gerektirdiği için, diğer testlerle birlikte Kalsitriol Aktif/Vitamin D (1,25 Hidroksi) kan düzeylerini kontrol etmek, VDR direncinin derecesini gösterebilir.
-
KAYNAKÇA
- Molecular mechanisms of vitamin D action. Calcified tissue international, 92(2), 77–98. https://doi.org/10.1007/s00223-012-9619-0
- Haussler, M. R., Whitfield, G. K., Kaneko, I., Haussler, C. A., Hsieh, D., Hsieh, J. C., & Jurutka, P. W. (2013).
- Lips, P., & van Schoor, N. M. (2011). The effect of vitamin D on bone and osteoporosis. Best practice & research. Clinical endocrinology & metabolism, 25(4), 585–591. https://doi.org/10.1016/j.beem.2011.05.002
- Garland, C. F., Garland, F. C., Gorham, E. D., Lipkin, M., Newmark, H., Mohr, S. B., & Holick, M. F. (2006). The role of vitamin D in cancer prevention. American journal of public health, 96(2), 252–261. https://doi.org/10.2105/AJPH.2004.045260
- Schwalfenberg G. (2008). Vitamin D and diabetes: improvement of glycemic control with vitamin D3 repletion. Canadian family physician Medecin de famille canadien, 54(6), 864–866.
- Waterhouse, J. C., Perez, T. H., & Albert, P. J. (2009). Reversing bacteria-induced vitamin D receptor dysfunction is key to autoimmune disease. Annals of the New York Academy of Sciences, 1173, 757–765. https://doi.org/10.1111/j.1749- 6632.2009.04637.x
- Bassuk, S. S., & Manson, J. E. (2009). Does vitamin D protect against cardiovascular disease?. Journal of cardiovascular translational research, 2(3), 245–250. https://doi.org/10.1007/s12265-009-9111-z
- Annweiler, C., Schott, A. M., Berrut, G., Chauviré, V., Le Gall, D., Inzitari, M., & Beauchet, O. (2010). Vitamin D and ageing: neurological issues. Neuropsychobiology, 62(3), 139–150. https://doi.org/10.1159/000318570
- Barrea, L., Savanelli, M. C., Di Somma, C., Napolitano, M., Megna, M., Colao, A., & Savastano, S. (2017). Vitamin D and its role in psoriasis: An overview of the dermatologist and nutritionist. Reviews in endocrine & metabolic disorders, 18(2), 195–205. https://doi.org/10.1007/s11154-017-9411-6
- Yamshchikov, A. V., Desai, N. S., Blumberg, H. M., Ziegler, T. R., & Tangpricha, V. (2009). Vitamin D for treatment and prevention of infectious diseases: a systematic review of randomized controlled trials. Endocrine practice : official journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists, 15(5), 438–449. https://doi.org/10.4158/EP09101.ORR
- Salzer, J., Hallmans, G., Nyström, M., Stenlund, H., Wadell, G., & Sundström, P. (2012). Vitamin D as a protective factor in multiple sclerosis. Neurology, 79(21), 2140–2145. https://doi.org/10.1212/WNL.0b013e3182752ea8
- Shen, S. Y., Xiao, W. Q., Lu, J. H., Yuan, M. Y., He, J. R., Xia, H. M., Qiu, X., Cheng,
- K. K., & Lam, K. B. H. (2018). Early life vitamin D status and asthma and wheeze: a systematic review and meta-analysis. BMC pulmonary medicine, 18(1), 120. https://doi.org/10.1186/s12890-018-0679-4
- Paul, G., Brehm, J. M., Alcorn, J. F., Holguín, F., Aujla, S. J., & Celedón, J. C. (2012).
- Vitamin D and asthma. American journal of respiratory and critical care medicine, 185(2), 124–132. https://doi.org/10.1164/rccm.201108-1502CI
- Arfian, N., Muflikhah, K., Soeyono, S. K., Sari, D. C., Tranggono, U., Anggorowati, N., & Romi, M. M. (2016). Vitamin D Attenuates Kidney Fibrosis via Reducing Fibroblast Expansion, Inflammation, and Epithelial Cell Apoptosis. The Kobe journal of medical sciences, 62(2), E38–E44.
- Tamez, H., Kalim, S., & Thadhani, R. I. (2013). Does vitamin D modulate blood pressure?. Current opinion in nephrology and hypertension, 22(2), 204–209. https://doi.org/10.1097/MNH.0b013e32835d919b
- Aranow C. (2011). Vitamin D and the immune system. Journal of investigative medicine : the official publication of the American Federation for Clinical Research, 59(6), 881–886. https://doi.org/10.2310/JIM.0b013e31821b8755
- Ardizzone, S., Cassinotti, A., Trabattoni, D., Manzionna, G., Rainone, V., Bevilacqua, M., Massari, A., Manes, G., Maconi, G., Clerici, M., & Bianchi Porro, G. (2009). Immunomodulatory effects of 1,25-dihydroxyvitamin D3 on TH1/TH2 cytokines in inflammatory bowel disease: an in vitro study. International journal of immunopathology and pharmacology, 22(1), 63–71. https://doi.org/10.1177/039463200902200108
- Irani, M., Seifer, D. B., Grazi, R. V., Julka, N., Bhatt, D., Kalgi, B., Irani, S., Tal, O., Lambert-Messerlian, G., & Tal, R. (2015). Vitamin D Supplementation Decreases TGF-β1 Bioavailability in PCOS: A Randomized Placebo-Controlled Trial. The Journal of clinical endocrinology and metabolism, 100(11), 4307–4314. https://doi.org/10.1210/jc.2015-2580
- Cantorna, M. T., Zhao, J., & Yang, L. (2012). Vitamin D, invariant natural killer T-cells and experimental autoimmune disease. The Proceedings of the Nutrition Society, 71(1), 62–66. https://doi.org/10.1017/S0029665111003193
- Mariani, E., Ravaglia, G., Meneghetti, A., Tarozzi, A., Forti, P., Maioli, F., Boschi, F., & Facchini, A. (1998). Natural immunity and bone and muscle remodelling hormones in the elderly. Mechanisms of ageing and development, 102(2-3), 279–292. https://doi.org/10.1016/s0047-6374(97)00173-5
- Cranney, A., Horsley, T., O’Donnell, S., Weiler, H., Puil, L., Ooi, D., Atkinson, S., Ward, L., Moher, D., Hanley, D., Fang, M., Yazdi, F., Garritty, C., Sampson, M., Barrowman, N., Tsertsvadze, A., & Mamaladze, V. (2007). Effectiveness and safety of vitamin D in relation to bone health. Evidence report/technology assessment, (158), 1–235.
- Peppone, L. J., Hebl, S., Purnell, J. Q., Reid, M. E., Rosier, R. N., Mustian, K. M., Palesh, O. G., Huston, A. J., Ling, M. N., & Morrow, G. R. (2010). The efficacy of calcitriol therapy in the management of bone loss and fractures: a qualitative review. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis
- Foundation of the USA, 21(7), 1133–1149. https://doi.org/10.1007/s00198-009-1136-2
- Reschly, E. J., & Krasowski, M. D. (2006). Evolution and function of the NR1I nuclear hormone receptor subfamily (VDR, PXR, and CAR) with respect to metabolism of xenobiotics and endogenous compounds. Current drug metabolism, 7(4), 349–365. https://doi.org/10.2174/138920006776873526
- Luderer, H. F., & Demay, M. B. (2010). The vitamin D receptor, the skin and stem cells. The Journal of steroid biochemistry and molecular biology, 121(1-2), 314–316. https://doi.org/10.1016/j.jsbmb.2010.01.015
- Fleet, J. C., & Schoch, R. D. (2010). Molecular mechanisms for regulation of intestinal calcium absorption by vitamin D and other factors. Critical reviews in clinical laboratory sciences, 47(4), 181–195. https://doi.org/10.3109/10408363.2010.536429
- Cui, X., Pertile, R., Liu, P., & Eyles, D. W. (2015). Vitamin D regulates tyrosine hydroxylase expression: N-cadherin a possible mediator. Neuroscience, 304, 90–100. https://doi.org/10.1016/j.neuroscience.2015.07.048
- Jiang, P., Zhang, L. H., Cai, H. L., Li, H. D., Liu, Y. P., Tang, M. M., Dang, R. L., Zhu,
- W. Y., Xue, Y., & He, X. (2014). Neurochemical effects of chronic administration of calcitriol in rats. Nutrients, 6(12), 6048–6059. https://doi.org/10.3390/nu6126048
- Puchacz, E., Stumpf, W. E., Stachowiak, E. K., & Stachowiak, M. K. (1996). Vitamin D increases expression of the tyrosine hydroxylase gene in adrenal medullary
- cells. Brain research. Molecular brain research, 36(1), 193–196. https://doi.org/10.1016/0169-328x(95)00314-i
- Gatto, N. M., Sinsheimer, J. S., Cockburn, M., Escobedo, L. A., Bordelon, Y., & Ritz,
- B. (2015). Vitamin D receptor gene polymorphisms and Parkinson’s disease in a population with high ultraviolet radiation exposure. Journal of the neurological sciences, 352(1-2), 88–93. https://doi.org/10.1016/j.jns.2015.03.043
- Lundqvist, J., Norlin, M., & Wikvall, K. (2011). 1α,25-Dihydroxyvitamin D3 exerts tissue-specific effects on estrogen and androgen metabolism. Biochimica et biophysica acta, 1811(4), 263–270. https://doi.org/10.1016/j.bbalip.2011.01.004
- Chen, G., Kim, S. H., King, A. N., Zhao, L., Simpson, R. U., Christensen, P. J., Wang,
- Z., Thomas, D. G., Giordano, T. J., Lin, L., Brenner, D. E., Beer, D. G., & Ramnath, N. (2011). CYP24A1 is an independent prognostic marker of survival in patients with lung adenocarcinoma. Clinical cancer research : an official journal of the American Association for Cancer Research, 17(4), 817–826. https://doi.org/10.1158/1078- 0432.CCR-10-1789
- Lopes, N., Sousa, B., Martins, D., Gomes, M., Vieira, D., Veronese, L. A., Milanezi, F., Paredes, J., Costa, J. L., & Schmitt, F. (2010). Alterations in Vitamin D signalling and metabolic pathways in breast cancer progression: a study of VDR, CYP27B1 and CYP24A1 expression in benign and malignant breast lesions. BMC cancer, 10, 483. https://doi.org/10.1186/1471-2407-10-483
- Castillo, A. I., Jimenez-Lara, A. M., Tolon, R. M., & Aranda, A. (1999). Synergistic activation of the prolactin promoter by vitamin D receptor and GHF-1: role of the coactivators, CREB-binding protein and steroid hormone receptor coactivator-1 (SRC-1). Molecular endocrinology (Baltimore, Md.), 13(7), 1141–1154. https://doi.org/10.1210/mend.13.7.0320
- Zittermann, A., Sabatschus, O., Jantzen, S., Platen, P., Danz, A., Dimitriou, T., Scheld, K., Klein, K., & Stehle, P. (2000). Exercise-trained young men have higher calcium absorption rates and plasma calcitriol levels compared with age-matched sedentary controls. Calcified tissue international, 67(3), 215–219. https://doi.org/10.1007/s002230001132
- Zittermann, A., Sabatschus, O., Jantzen, S., Platen, P., Danz, A., & Stehle, P. (2002). Evidence for an acute rise of intestinal calcium absorption in response to aerobic exercise. European journal of nutrition, 41(5), 189–196. https://doi.org/10.1007/s00394-002-0375-1
- Armbrecht, H. J., Forte, L. R., Wongsurawat, N., Zenser, T. V., & Davis, B. B. (1984).
- Forskolin increases 1,25-dihydroxyvitamin D3 production by rat renal slices in vitro. Endocrinology, 114(2), 644–649. https://doi.org/10.1210/endo-114-2-644
- Dampf Stone, A., Batie, S. F., Sabir, M. S., Jacobs, E. T., Lee, J. H., Whitfield, G. K., Haussler, M. R., & Jurutka, P. W. (2015). Resveratrol potentiates vitamin D and nuclear receptor signaling. Journal of cellular biochemistry, 116(6), 1130–1143. https://doi.org/10.1002/jcb.25070
- Savkur, R. S., Bramlett, K. S., Stayrook, K. R., Nagpal, S., & Burris, T. P. (2005). Coactivation of the human vitamin D receptor by the peroxisome proliferator-activated receptor gamma coactivator-1 alpha. Molecular pharmacology, 68(2), 511–517. https://doi.org/10.1124/mol.105.012708
- Matkovits, T., & Christakos, S. (1995). Ligand occupancy is not required for vitamin D receptor and retinoid receptor-mediated transcriptional activation. Molecular endocrinology (Baltimore, Md.), 9(2), 232–242. https://doi.org/10.1210/mend.9.2.7776973
- Han, S., Li, T., Ellis, E., Strom, S., & Chiang, J. Y. (2010). A novel bile acid-activated vitamin D receptor signaling in human hepatocytes. Molecular endocrinology (Baltimore, Md.), 24(6), 1151–1164. https://doi.org/10.1210/me.2009-0482
- Haussler, M. R., Haussler, C. A., Bartik, L., Whitfield, G. K., Hsieh, J. C., Slater, S., & Jurutka, P. W. (2008). Vitamin D receptor: molecular signaling and actions of nutritional ligands in disease prevention. Nutrition reviews, 66(10 Suppl 2), S98– S112. https://doi.org/10.1111/j.1753-4887.2008.00093.x
- Vidal, M., Ramana, C. V., & Dusso, A. S. (2002). Stat1-vitamin D receptor interactions antagonize 1,25-dihydroxyvitamin D transcriptional activity and enhance stat1- mediated transcription. Molecular and cellular biology, 22(8), 2777–2787. https://doi.org/10.1128/MCB.22.8.2777-2787.2002
- Liel, Y., Shany, S., Smirnoff, P., & Schwartz, B. (1999). Estrogen increases 1,25- dihydroxyvitamin D receptors expression and bioresponse in the rat duodenal mucosa. Endocrinology, 140(1), 280–285. https://doi.org/10.1210/endo.140.1.6408
- Gilad, L. A., Bresler, T., Gnainsky, J., Smirnoff, P., & Schwartz, B. (2005). Regulation of vitamin D receptor expression via estrogen-induced activation of the ERK 1/2 signaling pathway in colon and breast cancer cells. The Journal of endocrinology, 185(3), 577–592. https://doi.org/10.1677/joe.1.05770

Siz de fikrinizi belirtin