Reicht eine alleinige Vitamin-D-Supplementierung für die gesundheitlichen Vorteile von Vitamin D aus? Die Bedeutung der Vitamin-D-Reduktion (VDR)
Viele Menschen glauben, dass die Einnahme von Vitamin-D3-Präparaten allein ausreicht, um die Vorteile von Vitamin D zu nutzen. Vitamin D3 allein ist jedoch oft nicht ausreichend. Der Vitamin-D-Rezeptor (VDR) erfüllt zudem zahlreiche weitere, äußerst wichtige Funktionen.
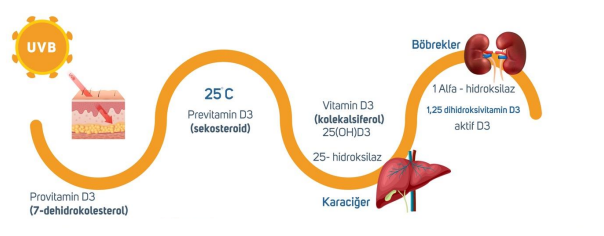
Voraussetzungen für die Gewinnung von aktivem Vitamin D und die anschließende Beschaffung
Wir neigen dazu, Vitamin D3 als Ursache vieler gesundheitlicher Effekte zu betrachten; in Wirklichkeit ist Vitamin D3 jedoch nur der Anfang des Prozesses, der zu diesen Vorteilen führt.
Wenn UVB-Strahlen des Sonnenlichts unter geeigneten Bedingungen auf unsere unbedeckte Haut treffen , finden in verschiedenen Organen enzymatische Reaktionen statt. Ein Enzym ist ein Protein. Ein Protein ist die Gensequenz, die für dieses Protein codiert.
*Geeignete Bedingungen: Während der Zeiträume, in denen der Zenitwinkel der Sonne am jeweiligen Standort am geringsten ist (Mai-Oktober in der Türkei, Mittagszeit), können etwa 18-20 mJ Sonnenlicht mit einer Wellenlänge von 290-310 nm, die etwa 10 Minuten lang direkt auf unbedeckte, nicht dunkelhäutige menschliche Haut ohne Sonnenschutz fallen , 10.000-20.000 IE Vitamin D produzieren.
Provitamin D3 wird nach dem Kontakt der Haut mit ultravioletten B-Strahlen (UVB-Strahlen) in Prävitamin D3 umgewandelt. Dieses wird dann in der Leber durch das vom Gen CYP2R1 kodierte Enzym 25-Hydroxylase in Vitamin D3 (25-OH-D3/Cholecalciferol) umgewandelt.
Selbst wenn die Stoffwechselwege zur Vitamin-D3-Produktion erfolgreich abgeschlossen sind, ist dies nicht ausreichend; Vitamin D3 muss zusätzlich in seine aktive Form, Calcitriol, umgewandelt werden. Dieser Prozess findet in den Nieren statt, wo Cholecalciferol durch das vom Gen CYP27B1 kodierte Enzym 1-alpha-Hydroxylase in die aktive Form Calcitriol (1,25-Dihydroxyvitamin D3) umgewandelt wird. (Überschüssiges Calcitriol wird durch die vom Gen CYP24A1 kodierte 24-Hydroxylase inaktiviert.) Abbildung 1.
Abbildung 1.

Calcitriol muss anschließend von Transportproteinen (GCs) transportiert werden, um erfolgreich an den Vitamin-D-Rezeptor (VDR) zu binden. Dies erfordert einen intakten genetischen Code des Transportproteins und eine intakte Rezeptorstruktur.
Abgesehen von genetischen Problemen wie den relativ häufigen Einzelnukleotid-Polymorphismen (SNPs) blockieren auch bestimmte Infektionen und Toxine diese Rezeptoren. In solchen Fällen zeigen weder Calcitriol noch Vitamin D3 gesundheitliche Vorteile.
Nachdem Calcitriol erfolgreich an den Vitamin-D-Rezeptor (VDR) gebunden hat, muss ein spezifischer Vitamin-Rezeptor-Komplex gebildet werden, um zahlreiche physiologische Funktionen wie normale Zellproliferation und Apoptose aufrechtzuerhalten. Dieser Komplex ist ein wichtiges Mitglied der Kernrezeptor-Superfamilie. Für die Bildung des Komplexes muss das an den VDR gebundene Calcitriol an den Retinoid-X-Rezeptor (RXR) binden, der durch aktives Vitamin A aktiviert wird, und so ein Dimer bilden. Der VDR-Calcitriol-RXR-Komplex kann nach Erreichen des Zellkerns Gene regulieren, die das Vitamin-D-Response-Element (VDRE) in ihrer Promotorregion enthalten. Abbildung 2.
Abbildung 2.

Im Anschluss daran können zellspezifische Reaktionen erfolgen und die Expression spezifischer Gene, die für Proteine kodieren, welche die Wirkung von Vitamin D regulieren, kann gesteuert werden. Die hier stattfindenden Genexpressionen machen 10 % der gesamten Genexpression aus. Da Vitamin-D-Rezeptoren (VDRs) vermutlich in etwa 31 Organen vorkommen, verdeutlicht dieser Prozentsatz die Bedeutung von Vitamin D3 und aller nachfolgenden Prozesse für das Überleben und die Erhaltung eines gesunden Lebens.
Um die gesundheitlichen Vorteile von Vitamin D zu nutzen, ist zunächst eine ausreichende Vitamin-D-Zufuhr erforderlich. Nahrungsergänzungsmittel sind in diesem Stadium sinnvoll. Man sollte jedoch nicht vergessen, dass die Aufnahme von aktivem Vitamin D einen gesunden genetischen Code, gesunde Enzyme, gesunde Transporter, einen gesunden Rezeptor und einen Vitamin-A-aktivierten RXR voraussetzt. Daher kann Vitamin A bei Bedarf zusätzlich eingenommen werden. Da die Epigenetik uns gelehrt hat, dass wir unseren genetischen Code verändern können, ist es auch sinnvoll, diesen durch unseren Lebensstil und unsere Ernährung zu optimieren.
wird sein.
Vorteile von Vitamin D3
Calcitriol, die aktive Form von Vitamin D, hat zahlreiche Vorteile. Vitamin D schützt vor:
-
Osteoporose
-
Krebs
-
Diabetes (Typ 1 und Typ 2)
-
Herzkrankheiten
-
Neurologische Erkrankungen
-
Schuppenflechte
-
Infektionen
-
Multiple Sklerose
-
Asthma
-
Nierenentzündung und Tod aufgrund von Nierenerkrankungen (ein Rückgang des Kreatininspiegels ist zu erwarten)
-
Bluthochdruck (unterdrückt das Renin-Angiotensin-System)
-
Lupus / SLE
-
Arthritis
-
Sklerodermie
-
Sarkoidose
-
Sjögren-Syndrom
-
Autoimmunerkrankungen der Schilddrüse (Hashimoto-Thyreoiditis, Morbus Basedow)
-
Spondylitis ankylosans
-
Reiter-Syndrom
-
Uveitis
Vitamin D ist besonders vorteilhaft für Personen mit einem Th1- und Th17 – dominanten Immunprofil .
Die entzündungshemmende Rolle von Vitamin D
Vitamin D unterdrückt in erster Linie das adaptive Immunsystem .
-
Es hemmt die Proliferation von B-Zellen.
-
Es reduziert die Sekretion von Immunglobulin (Ig).
-
Es hemmt die T-Zell-Proliferation.
-
Es ermöglicht Ihnen den Wechsel von Th1 zu Th2.
-
Es unterdrückt Th17
-
Es erhöht die Anzahl der Tregs und IL-10s.
-
Es reduziert entzündliche Zytokine (IL-1, IL-6, IL-8, IL-12, TNF-α, IL-17, IL-21)
-
Es senkt den TGF-beta-Spiegel.
-
Es hemmt die Differenzierung und Reifung dendritischer Zellen durch Verringerung der Expression von MHC II und kostimulatorischen Molekülen.
Stärkt das Immunsystem
Vitamin D stimuliert außerdem das natürliche ( angeborene) Immunsystem :
-
Es ist für die Aktivierung von T-Zellen von entscheidender Bedeutung; insofern hat es eine immunverstärkende Wirkung.
-
Es erhöht die Anzahl der CD8+ T-Zellen, die für die Bekämpfung von Virusinfektionen wichtig sind.
-
Es erhöht die Anzahl der natürlichen Killer-T-Zellen (NKT) – vorteilhaft bei Autoimmunerkrankungen, kann aber bei Asthma nachteilig sein.
-
Es erhöht die Anzahl der NK-Zellen.
-
Es erhöht die Freisetzung antimikrobieller Wirkstoffe wie Cathelicidin und Beta-Defensin-4 als Reaktion auf eine Infektion.
Weitere Vorteile von Vitamin-D-Rezeptoren
Der bekannteste Nutzen von Vitamin D3 ist seine positive Wirkung auf die Knochengesundheit .
-
Niedrige Vitamin-D3-Werte im Blut gehen mit einer geringen Knochendichte einher.
-
Klinische Studien haben gezeigt, dass Calcitriol für Menschen mit geringer Knochendichte von Vorteil ist.
Die VDR-Aktivierung erhöht die Expression von Phase-I-Entgiftungsenzymen in Leber und Darm (z. B. CYP2C9, CYP3A4), die eine entscheidende Rolle im Arzneimittel- und Toxinstoffwechsel spielen.
Vitamin-D-Rezeptoren sind wichtig für das Haarwachstum; bei Versuchstieren ist der Verlust von VDR mit Haarausfall verbunden.
Der Vitamin-D-Rezeptor (VDR) reguliert den Transport von Kalzium, Eisen und anderen Mineralien aus dem Darm.
Da viele Infektionen den Vitamin-D-Rezeptor (VDR) blockieren (ventrikulärer Defekt), kann der Körper diese Krankheitserreger nicht effektiv bekämpfen. Forscher haben in vielen Fällen erfolgreich Kombinationen aus Calcitriol und Antibiotika eingesetzt. Um Immunreaktionen zu reduzieren, wird empfohlen, die Krankheitserreger über Jahre hinweg schrittweise zu eliminieren.
Calcitriol/VDR erhöht den Dopaminspiegel durch Steigerung der Tyrosinhydroxylase, dem geschwindigkeitsbestimmenden Enzym der Dopaminproduktion.
Dieser Effekt ist im Hypothalamus, den Nebennieren, der Substantia nigra und möglicherweise weiteren Hirnregionen zu beobachten. Er führt zu einer erhöhten Produktion von Dopamin, Adrenalin und Noradrenalin. Allerdings kann die Tyrosinhydroxylase auch oxidativen Stress verstärken.
Calcitriol erhöht den GABA-Spiegel durch Steigerung von GAD67. Calcitriol erhöht außerdem GDNF, welches Dopaminneuronen schützt (in vitro).
Forscher vermuten, dass ein Mangel an zirkulierendem Vitamin D zu einer Funktionsstörung der Substantia nigra führen kann, wo bei der Parkinson-Krankheit eine dopaminerge Degeneration auftritt.
Ein Vitamin-D-Mangel tritt häufig bei Parkinson-Patienten auf, und die Krankheit ist mit einer niedrigen Knochendichte verbunden.
Die Wirkung von aktivem Vitamin D auf Krebs variiert je nach Gewebe.
-
Bei Brustkrebs nehmen Östrogen und Aromatase ab, während Testosteron/Androgene zunehmen (positiv).
-
DHT-Spiegel sinkt bei Nebennierenkrebs (positiv)
-
Bei Prostatakrebs steigen die Testosteron- und DHT-Spiegel (negativ).
Bei Lungen- und Brustkrebs wurden erhöhte Konzentrationen des Enzyms beobachtet, das aktives Vitamin D abbaut; dies lässt vermuten, dass eine Erhöhung der Konzentration von aktivem Vitamin D von Vorteil sein könnte.
Aktives Vitamin D erhöht die Prolaktinproduktion.
Technik: 1,25D; reguliert RANKL, SPP1 und Osteocalcin für den Knochenmineralumbau; TRPV6, CaBP(9k) und Claudin-2 für die intestinale Calciumabsorption; und TRPV5, Klotho und Npt2c für die renale Calcium- und Phosphatrückresorption.
Natürliche Wege zur Steigerung der Calcitriol- und Vitamin-D-Rezeptor-(VDR)-Genexpression
-
Sport erhöht den Calcitriolspiegel.
-
RXR (und Retinol) werden für die Proteinproduktion mit VDR benötigt. 1,25-D3 bindet an VDR und assoziiert anschließend mit RXR, um die Genexpression zu aktivieren. (Nicht alle VDR-abhängigen Gene benötigen RXR.)
-
Probiotische Ergänzung mit Lactobacillus rhamnossus GG und L. reuteri .
-
Parathormon (PTH) – erhöht Calcitriol/1,25 D3 und erhöht PTH-verwandtes Peptid,
-
SIRT1 verstärkt die Wirkung von VDR – Die Acetylierung von VDR reduziert die 1,25D/VDR-Signalübertragung. SIRT1 verstärkt die Fähigkeit von VDR, mit RXR zu assoziieren/zu binden.
-
PGC-1α verstärkt die Wirkung des VDR. Es ist ein Koaktivator des VDR, benötigt aber dennoch 1,25D3.
-
Dopamin
-
Galle – insbesondere Lithocolinsäure (LCA). Der Vitamin-D-Rezeptor (VDR) entwickelte sich aus einer Struktur, deren ursprüngliche Funktion die eines entgiftenden nukleären Rezeptors war. LCA wird von Darmbakterien (durch den Metabolismus der in der Leber gebildeten Chenodesoxycholsäure) produziert. LCA gelangt in den Dickdarm; dort bindet der VDR an LCA oder 1,25D und aktiviert die Gene CYP3A4 und SULT2A, welche den Abtransport aus der Zelle über den ABC-Effluxtransporter ermöglichen.
-
Omega-3: DHA, EPA – Fischöl/DHA
-
Omega-6 : γ-Linolensäure, Arachidonsäure
-
Curcumin – Curcumin ist bei der Hemmung der VDR-vermittelten Transkription aktiver als LCA/Galle und bindet mit etwa der gleichen Affinität an VDR wie LCA.
-
Resveratrol potenziert VDR auf folgende Weise: (1) durch Potenzierung der Bindung von 1,25D an VDR; (2) durch Aktivierung von RXR; (3) durch Stimulation von SIRT1.
-
Forskolin erhöht 25D3 in vitro auf 1,25D3.
-
Gamma- Tocotrienol – Tocotrienole oder Tocopherole (IHERB)
-
Vitamin E/alpha-Tocopherol konkurriert nicht mit Calcitriol um den Vitamin-D-Rezeptor.
-
Dexamethason – konkurriert nicht mit 1,25.
-
Die Behandlung mit Interferon-gamma (IFN-γ) hemmte die Induktion der 24-Hydroxylase (des Enzyms, das 1,25D3 abbaut) von 1,25D3. Dies bedeutet, dass die Konzentration von 1,25D3 erhöht war. (Technisch: IFN-γ veränderte weder die basale Promotoraktivität noch die Bindung von 1,25D an den Vitamin-D-Rezeptor.)
oder veränderten die nukleären VDR-Spiegel nicht. (IFN-γ stört die Bindung von VDR-RXR an VDRE über einen Stat1-vermittelten Mechanismus.)
-
Estradiol erhöht die VDR-Expression und den Calcitriolspiegel.
-
Phytoöstrogene
-
Testosteron
-
Prostaglandine
-
Bisphosphonate
DHA, EPA, Linolsäure und Arachidonsäure aktivieren zusammen den VDR im Vergleich zu 1,25 D3.
Es ist 10.000 Mal weniger effektiv.
Curcumin ist bei der Induktion der VDR-Genexpression 1.000-mal weniger wirksam als 1,25 D3. Curcumin und Galle weisen eine ähnliche Bindungsfähigkeit an VDR und ähnliche Genexpressionsniveaus auf.
Curcumin, Gallensäure, DHA, EPA und Arachidonsäure konkurrieren mit 1,25D3 um die Bindung. Dexamethason und Alpha-Tocopherol konkurrieren nicht.
Natürlich stellt sich die Frage: Würden konkurrierende Steckverbinder mit deutlich geringerer Verbindungskapazität zum VDR trotzdem funktionieren? Die Antwort scheint ja zu lauten.
In ausgewählten Zellen oder Geweben können sich hohe Konzentrationen von PUFAs bilden und biologische Aktivität zeigen.
Eine übermäßige Gabe von Galle/LCA an Mäuse führte zum gleichen Effekt wie die Gabe von 1,25D3 (insbesondere zur Aktivierung des Kalziumtransports).
Nierengewebe kann etwa 1,25 % Vitamin D enthalten.
Faktoren, die VDR oder Calcitriol unterdrücken
-
Koffein
-
Cortisol / Glukokortikoide
-
Prolaktin
-
Schilddrüsenhormone
-
TGF-beta
-
TNF
-
Kortikosteroide
-
Phosphatonin, Ketoconazol, Heparin, Thiazide
-
Ubiquitin
Krankheitserreger, die den Vitamin-D-Rezeptor (VDR) hemmen
Viele Krankheitserreger hemmen einen Aspekt des Vitamin-D-Systems – entweder den Vitamin-D-Rezeptor (VDR), die Bindungsfähigkeit von Molekülen an den VDR oder die Fähigkeit des VDR, die Genexpression zu steuern. Dies sind nur einige Beispiele; ich glaube jedoch nicht, dass ich alle aktuell bekannten wissenschaftlichen Erkenntnisse abgedeckt habe.
-
-
P. aeruginosa (meist im Krankenhaus erworben). Es produziert den Sulfonolipid-Liganden Capnin. Antibiotika sind dagegen wirkungslos.
-
Helicobacter pylori (Verursacher von Magengeschwüren). Kommt bei 50 % der Weltbevölkerung vor. Produziert den Sulfonolipid-Liganden Capnin.
-
Lyme/Borrelia – Lebende Borrelien (in Monozyten) reduzieren den VDR um das 50-Fache, und „tote“ Borrelien reduzieren ihn um das 8-Fache – Dies könnte erklären, warum Menschen nach einer Lyme-Infektion Autoimmunerkrankungen entwickeln.
-
Tuberkulose – Reduziert VDR um das 3,3-Fache.
-
Capnin wird von „gleitenden“ Biofilmbakterien gebildet.
-
Es wurde gezeigt – Capnine (Cytophaga, Capnocytophaga, Sporocytophaga und Flexibacter)
-
-
Chlamydia (trachomatis)
-
Shigella – eine im Stuhl vorkommende Alge, die Darmprobleme und Durchfall verursacht.
-
Bakterien erhöhen die Menge an Caspase-3, einem Protein, das die VDR-Struktur abbaut und dadurch die Fähigkeit des VDR zur Transkription von Genen einschränkt.
-
-
Mycobacterium leprase produziert mir-21, um mehrere mit dem Vitamin-D-Rezeptor (VDR) assoziierte Gene anzugreifen.
-
Das Epstein-Barr-Virus (EBV) reduziert den Vitamin-D-Rezeptor (VDR) um etwa das Fünffache. EBV blockiert außerdem die Fähigkeit des VDR, seine Produkte herzustellen.
-
HIV – Es bindet an VDR und hemmt dessen Umwandlung in das aktive D.
-
Aspergillus fumigatus – Bei Patienten mit Mukoviszidose wurde gezeigt, dass der Pilz A. fumigatus Gliotoxin absondert; dieses Toxin reduziert VDR dosisabhängig.
-
Das Zytomegalievirus (CMV) reduziert den VDR um das 2,2-fache.
-
Hepatitis-C-Virus – Es hemmt CYP24A1, das Enzym, das für den Abbau von überschüssigem 1,25-D verantwortlich ist.
-
Wenn bakterielle Produkte den Vitamin-D-Rezeptor blockieren, wird weniger CYP24A1 produziert, was zu einem Überschuss an aktivem Vitamin D führt, wie er bei vielen Autoimmunerkrankungen beobachtet wird.
Hohe Calcitriolwerte deuten auf eine entzündliche/Autoimmunerkrankung hin
Da bakterielle Produkte die Aktivität des Vitamin-D-Rezeptors (VDR) stören, wird die Expression des Enzyms CYP24 gehemmt, welches Calcitriol/1,25-D in seine inaktiven Metaboliten spaltet. Dadurch kann der 1,25-D-Spiegel ohne ein regulierendes Feedback-System ansteigen, was zu erhöhten Hormonwerten führt.
Studien belegen einen starken Zusammenhang zwischen diesen Autoimmunerkrankungen und 1,25-D-Spiegeln über 110 pmol/L (46 pg/mL), selbst wenn keine signifikant erhöhten Blutkalziumwerte vorliegen. In einer Gruppe von 100 Personen mit Autoimmunerkrankungen wiesen 38 Werte über 160 pmol/L (66,6 pg/mL) auf.
Bei Personen mit chronischen Entzündungen liegen die Spiegel des aktiven Vitamin D häufig zwischen 50 und 80 pg/ml.
Im Gegensatz dazu besteht nur ein geringer Zusammenhang mit Vitamin-D-Mangel oder anderen Entzündungsmarkern; daher kann davon ausgegangen werden, dass die Blutspiegel von Vitamin D3 oder 1,25-D ein sensibles Maß zur Beurteilung des Autoimmunerkrankungsstatus darstellen.
Eine erworbene Hormonresistenz wird auch als Resistenz gegen Insulin, Schilddrüsenhormone, Steroidhormone und Wachstumshormon-Releasing-Hormon (GHRH) bezeichnet; hohe Konzentrationen dieser Hormone werden bei einigen Autoimmunerkrankungen beobachtet.
Calcitriolspiegel und Vitamin D3 verstehen
Gängige Bluttests messen verschiedene Marker, die Aufschluss darüber geben, wie viel aktives Vitamin D Sie haben.
Folgende Werte deuten auf erhöhte Calcitriol-Werte hin:
-
-
Höhere Parathormonspiegel
-
Erhöhte Kalzium- und Phosphorwerte im Blut.
-
Höheres Albumin
-
Höheres Kreatinin
-
Niedrigere alkalische Phosphatase
-
Da zumindest einige (vielleicht sogar alle) dieser Substanzen den Vitamin-D-Rezeptor benötigen, kann die Überprüfung des Blutspiegels von Calcitriol Active/Vitamin D (1,25-Hydroxy) zusammen mit anderen Tests Aufschluss über den Grad der VDR-Resistenz geben.
QUELLE
- Molekulare Wirkmechanismen von Vitamin D. Calcified Tissue International, 92(2), 77–98. https://doi.org/10.1007/s00223-012-9619-0
- Haussler, M.R., Whitfield, G.K., Kaneko, I., Haussler, C.A., Hsieh, D., Hsieh, J.C., & Jurutka, P.W. (2013).
- Lips, P., & van Schoor, N. M. (2011). Die Wirkung von Vitamin D auf Knochen und Osteoporose. Best Practice & Research. Clinical Endocrinology & Metabolism, 25(4), 585–591. https://doi.org/10.1016/j.beem.2011.05.002
- Garland, C.F., Garland, F.C., Gorham, E.D., Lipkin, M., Newmark, H., Mohr, S.B. & Holick, M.F. (2006). Die Rolle von Vitamin D in der Krebsprävention. American Journal of Public Health, 96(2), 252–261. https://doi.org/10.2105/AJPH.2004.045260
- Schwalfenberg G. (2008). Vitamin D und Diabetes: Verbesserung der glykämischen Kontrolle durch Vitamin-D3-Supplementierung. Canadian family physician Medecin de famille canadien, 54(6), 864–866.
- Waterhouse, J. C., Perez, T. H. & Albert, P. J. (2009). Die Umkehrung der durch Bakterien verursachten Vitamin-D-Rezeptor-Dysfunktion ist der Schlüssel zur Autoimmunerkrankung. Annals of the New York Academy of Sciences, 1173, 757–765. https://doi.org/10.1111/j.1749-6632.2009.04637.x
- Bassuk, SS, & Manson, J. E. (2009). Schützt Vitamin D vor Herz-Kreislauf-Erkrankungen? Journal of cardiovascular translational research, 2(3), 245–250. https://doi.org/10.1007/s12265-009-9111-z
- Annweiler, C., Schott, A.M., Berrut, G., Chauviré, V., Le Gall, D., Inzitari, M. & Beauchet, O. (2010). Vitamin D und Altern: neurologische Probleme. Neuropsychobiology, 62(3), 139–150. https://doi.org/10.1159/000318570
- Barrea, L., Savanelli, M.C., Di Somma, C., Napolitano, M., Megna, M., Colao, A. & Savastano, S. (2017). Vitamin D und seine Rolle bei Psoriasis: Ein Überblick aus dermatologischer und ernährungswissenschaftlicher Sicht. Reviews in endocrine & metabolic disorders, 18(2), 195–205. https://doi.org/10.1007/s11154-017-9411-6
- Yamshchikov, AV, Desai, NS, Blumberg, HM, Ziegler, TR & Tangpricha, V. (2009). Vitamin D zur Behandlung und Prävention von Infektionskrankheiten: eine systematische Übersicht randomisierter kontrollierter Studien. Endocrine practice: official journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists, 15(5), 438–449. https://doi.org/10.4158/EP09101.ORR
- Salzer, J., Hallmans, G., Nyström, M., Stenlund, H., Wadell, G. & Sundström, P. (2012). Vitamin D als Schutzfaktor bei Multipler Sklerose. Neurology, 79(21), 2140–2145. https://doi.org/10.1212/WNL.0b013e3182752ea8
- Shen, SY, Xiao, WQ, Lu, JH, Yuan, MY, He, JR, Xia, HM, Qiu, X., Cheng,
- KK & Lam, KBH (2018). Vitamin-D-Status im frühen Kindesalter und Asthma sowie Giemen: eine systematische Übersichtsarbeit und Metaanalyse. BMC Pulmonary Medicine, 18(1), 120. https://doi.org/10.1186/s12890-018-0679-4
- Paul, G., Brehm, J. M., Alcorn, J. F., Holguín, F., Aujla, S. J., & Celedón, J. C. (2012).
- Vitamin D und Asthma. American Journal of Respiratory and Critical Care Medicine, 185(2), 124–132. https://doi.org/10.1164/rccm.201108-1502CI
- Arfian, N., Muflikhah, K., Soeyono, S.K., Sari, D.C., Tranggono, U., Anggorowati, N. & Romi, M.M. (2016). Vitamin D mildert Nierenfibrose durch Reduzierung der Fibroblastenproliferation, der Entzündung und der Apoptose von Epithelzellen. The Kobe Journal of Medical Sciences, 62(2), E38–E44.
- Tamez, H., Kalim, S. & Thadhani, R. I. (2013). Moduliert Vitamin D den Blutdruck? Current Opinion in Nephrology and Hypertension, 22(2), 204–209. https://doi.org/10.1097/MNH.0b013e32835d919b
- Aranow C. (2011). Vitamin D und das Immunsystem. Journal of investigative medicine: the official publication of the American Federation for Clinical Research, 59(6), 881–886. https://doi.org/10.2310/JIM.0b013e31821b8755
- Ardizzone, S., Cassinotti, A., Trabattoni, D., Manzionna, G., Rainone, V., Bevilacqua, M., Massari, A., Manes, G., Maconi, G., Clerici, M. & Bianchi Porro, G. (2009). Immunmodulatorische Wirkungen von 1,25-Dihydroxyvitamin D3 auf TH1/TH2-Zytokine bei entzündlichen Darmerkrankungen: eine In-vitro-Studie. Internationale Zeitschrift für Immunpathologie und Pharmakologie, 22(1), 63–71. https://doi.org/10.1177/039463200902200108
- Irani, M., Seifer, D.B., Grazi, R.V., Julka, N., Bhatt, D., Kalgi, B., Irani, S., Tal, O., Lambert-Messerlian, G. & Tal, R. (2015). Vitamin-D-Supplementierung verringert die Bioverfügbarkeit von TGF-β1 bei PCOS: Eine randomisierte, placebokontrollierte Studie. The Journal of clinical endocrinology and metabolism, 100(11), 4307–4314. https://doi.org/10.1210/jc.2015-2580
- Cantorna, M. T., Zhao, J. & Yang, L. (2012). Vitamin D, invariante natürliche Killer-T-Zellen und experimentelle Autoimmunerkrankung. The Proceedings of the Nutrition Society, 71(1), 62–66. https://doi.org/10.1017/S0029665111003193
- Mariani, E., Ravaglia, G., Meneghetti, A., Tarozzi, A., Forti, P., Maioli, F., Boschi, F. & Facchini, A. (1998). Natürliche Immunität und Knochen- und Muskelumbauhormone im Alter. Mechanisms of aging and development, 102(2-3), 279–292. https://doi.org/10.1016/s0047-6374(97)00173-5
- Cranney, A., Horsley, T., O’Donnell, S., Weiler, H., Puil, L., Ooi, D., Atkinson, S., Ward, L., Moher, D., Hanley, D., Fang, M., Yazdi, F., Garritty, C., Sampson, M., Barrowman, N., Tsertsvadze, A. & Mamaladze, V. (2007). Wirksamkeit und Sicherheit von Vitamin D in Bezug auf die Knochengesundheit. Evidenzbericht/Technologiebewertung, (158), 1–235.
- Peppone, L. J., Hebl, S., Purnell, J. Q., Reid, ME, Rosier, RN, Mustian, K. M., Palesh, OG, Huston, A. J., Ling, M. N. & Morrow, GR (2010). Die Wirksamkeit der Calcitriol-Therapie bei der Behandlung von Knochenverlust und Frakturen: eine qualitative Übersicht. Osteoporosis International: Eine Zeitschrift, die aus der Zusammenarbeit der Europäischen Stiftung für Osteoporose und der Nationalen Osteoporose-Stiftung hervorgegangen ist.
- Foundation of the USA, 21(7), 1133–1149. https://doi.org/10.1007/s00198-009-1136-2
- Reschly, E. J., & Krasowski, M. D. (2006). Evolution und Funktion der NR1I-Kernrezeptor-Subfamilie (VDR, PXR und CAR) im Hinblick auf den Metabolismus von Xenobiotika und endogenen Verbindungen. Current Drug Metabolism, 7(4), 349–365. https://doi.org/10.2174/138920006776873526
- Luderer, H.F., & Demay, M.B. (2010). Der Vitamin-D-Rezeptor, die Haut und Stammzellen. The Journal of steroid biochemistry and molecular biology, 121(1-2), 314–316. https://doi.org/10.1016/j.jsbmb.2010.01.015
- Fleet, J. C., & Schoch, R. D. (2010). Molekulare Mechanismen der Regulation der intestinalen Kalziumabsorption durch Vitamin D und andere Faktoren. Critical Reviews in Clinical Laboratory Sciences, 47(4), 181–195. https://doi.org/10.3109/10408363.2010.536429
- Cui, X., Pertile, R., Liu, P. & Eyles, D. W. (2015). Vitamin D reguliert die Tyrosinhydroxylase-Expression: N-Cadherin als möglicher Mediator. Neuroscience, 304, 90–100. https://doi.org/10.1016/j.neuroscience.2015.07.048
- Jiang, P., Zhang, LH, Cai, HL, Li, HD, Liu, YP, Tang, MM, Dang, RL, Zhu,
- W. Y., Xue, Y. & He, X. (2014). Neurochemische Effekte der chronischen Verabreichung von Calcitriol bei Ratten. Nutrients, 6(12), 6048–6059. https://doi.org/10.3390/nu6126048
- Puchacz, E., Stumpf, W. E., Stachowiak, E. K. & Stachowiak, M. K. (1996). Vitamin D erhöht die Expression des Tyrosinhydroxylase-Gens im Nebennierenmark
- Zellen. Hirnforschung. Molekulare Hirnforschung, 36(1), 193–196. https://doi.org/10.1016/0169-328x(95)00314-i
- Gatto, NM, Sinsheimer, JS, Cockburn, M., Escobedo, LA, Bordelon, Y., & Ritz,
- B. (2015). Vitamin-D-Rezeptor-Genpolymorphismen und Morbus Parkinson in einer Population mit hoher UV-Strahlungsexposition. Journal of the Neurological Sciences, 352(1-2), 88–93. https://doi.org/10.1016/j.jns.2015.03.043
- Lundqvist, J., Norlin, M. & Wikvall, K. (2011). 1α,25-Dihydroxyvitamin D3 übt gewebespezifische Wirkungen auf den Östrogen- und Androgenstoffwechsel aus. Biochimica et biophysica acta, 1811(4), 263–270. https://doi.org/10.1016/j.bbalip.2011.01.004
- Chen, G., Kim, SH, King, AN, Zhao, L., Simpson, RU, Christensen, PJ, Wang,
- Z., Thomas, D.G., Giordano, T.J., Lin, L., Brenner, D.E., Beer, D.G. & Ramnath, N. (2011). CYP24A1 ist ein unabhängiger prognostischer Marker für das Überleben von Patienten mit Lungenadenokarzinom. Clinical Cancer Research: An Official Journal of the American Association for Cancer Research, 17(4), 817–826. https://doi.org/10.1158/1078-0432.CCR-10-1789
- Lopes, N., Sousa, B., Martins, D., Gomes, M., Vieira, D., Veronese, L.A., Milanezi, F., Paredes, J., Costa, J.L. & Schmitt, F. (2010). Veränderungen der Vitamin-D-Signalwege und Stoffwechselwege bei der Progression von Brustkrebs: Eine Studie zur Expression von VDR, CYP27B1 und CYP24A1 in benignen und malignen Brustläsionen. BMC Cancer, 10, 483. https://doi.org/10.1186/1471-2407-10-483
- Castillo, A.I., Jimenez-Lara, A.M., Tolon, R.M. & Aranda, A. (1999). Synergistische Aktivierung des Prolaktin-Promotors durch den Vitamin-D-Rezeptor und GHF-1: Rolle der Koaktivatoren CREB-bindendes Protein und Steroidhormonrezeptor-Koaktivator-1 (SRC-1). Molecular Endocrinology (Baltimore, Md.), 13(7), 1141–1154. https://doi.org/10.1210/mend.13.7.0320
- Zittermann, A., Sabatschus, O., Jantzen, S., Platen, P., Danz, A., Dimitriou, T., Scheld, K., Klein, K. & Stehle, P. (2000). Trainierte junge Männer weisen im Vergleich zu altersgleichen, sitzenden Kontrollpersonen höhere Kalziumabsorptionsraten und Plasma-Calcitriolspiegel auf. Calcified Tissue International, 67(3), 215–219. https://doi.org/10.1007/s002230001132
- Zittermann, A., Sabatschus, O., Jantzen, S., Platen, P., Danz, A. & Stehle, P. (2002). Hinweise auf einen akuten Anstieg der intestinalen Kalziumabsorption als Reaktion auf Aerobic-Übungen. Europäisches Journal für Ernährung, 41(5), 189–196. https://doi.org/10.1007/s00394-002-0375-1
- Armbrecht, H. J., Forte, L. R., Wongsurawat, N., Zenser, T. V. & Davis, B. B. (1984).
- Forskolin erhöht die 1,25-Dihydroxyvitamin-D3-Produktion in Rattennierenschnitten in vitro. Endocrinology, 114(2), 644–649. https://doi.org/10.1210/endo-114-2-644
- Dampf Stone, A., Batie, SF, Sabir, MS, Jacobs, ET, Lee, JH, Whitfield, GK, Haussler, MR & Jurutka, PW (2015). Resveratrol potenziert die Vitamin-D- und Kernrezeptor-Signalübertragung. Journal of cellular biochemistry, 116(6), 1130–1143. https://doi.org/10.1002/jcb.25070
- Savkur, R.S., Bramlett, K.S., Stayrook, K.R., Nagpal, S. & Burris, T.P. (2005). Koaktivierung des humanen Vitamin-D-Rezeptors durch den Peroxisom-Proliferator-aktivierten Rezeptor-Gamma-Koaktivator-1α. Molecular Pharmacology, 68(2), 511–517. https://doi.org/10.1124/mol.105.012708
- Matkovits, T., & Christakos, S. (1995). Ligandenbindung ist für die Vitamin-D-Rezeptor- und Retinoidrezeptor-vermittelte Transkriptionsaktivierung nicht erforderlich. Molecular endocrinology (Baltimore, Md.), 9(2), 232–242. https://doi.org/10.1210/mend.9.2.7776973
- Han, S., Li, T., Ellis, E., Strom, S. & Chiang, J. Y. (2010). Ein neuartiger, durch Säure aktivierter Vitamin-D-Rezeptor-Signalweg in humanen Hepatozyten. Molecular Endocrinology (Baltimore, Md.), 24(6), 1151–1164. https://doi.org/10.1210/me.2009-0482
- Haussler, M.R., Haussler, C.A., Bartik, L., Whitfield, G.K., Hsieh, J.C., Slater, S. & Jurutka, P.W. (2008). Vitamin-D-Rezeptor: Molekulare Signalgebung und Wirkungen von Nährstoffliganden in der Krankheitsprävention. Nutrition Reviews, 66(10 Suppl 2), S98–S112. https://doi.org/10.1111/j.1753-4887.2008.00093.x
- Vidal, M., Ramana, C.V. & Dusso, A.S. (2002). Stat1-Vitamin-D-Rezeptor-Interaktionen antagonisieren die transkriptionelle Aktivität von 1,25-Dihydroxyvitamin D und verstärken die Stat1-vermittelte Transkription. Molecular and cellular biology, 22(8), 2777–2787. https://doi.org/10.1128/MCB.22.8.2777-2787.2002
- Liel, Y., Shany, S., Smirnoff, P. & Schwartz, B. (1999). Östrogen erhöht die Expression und Bioantwort von 1,25-Dihydroxyvitamin-D-Rezeptoren in der Duodenalschleimhaut der Ratte. Endocrinology, 140(1), 280–285. https://doi.org/10.1210/endo.140.1.6408
- Gilad, L.A., Bresler, T., Gnainsky, J., Smirnoff, P. & Schwartz, B. (2005). Regulation der Vitamin-D-Rezeptor-Expression durch Östrogen-induzierte Aktivierung des ERK1/2-Signalwegs in Dickdarm- und Brustkrebszellen. The Journal of Endocrinology, 185(3), 577–592. https://doi.org/10.1677/joe.1.05770

Hinterlasse einen Kommentar